Auteur : Paweł Radzikowski radzikpawe@gmail.com

Premier jour de contrôle (29.04.2024) : À son arrivée au German Living Lab, M. Paweł Radzikowski, de l'Ogolnopolskie Stowarzyszenie Agrolesnictwa (OSA, association polonaise d'agroforesterie), a rencontré Mme Janine Raabe, l'agricultrice de l'Ogolnopolskie Stowarzyszenie Agrolesnictwa. Hof Lebensberg. Les emplacements précis des sites d'échantillonnage ont été déterminés et des sites de contrôle ont été désignés. Les enquêtes ont été menées dans deux systèmes agroforestiers : un système mixte de fruits et un système mixte de noix. Le contrôle pour le système mixte de noix était un champ adjacent avec une culture fourragère, tandis que le système mixte de fruits était un champ adjacent non planté. Au cours des discussions sur place, le protocole d'échantillonnage développé à l'origine dans la tâche 3.2 a été décidé pour s'adapter aux conditions du site. Au lieu d'utiliser un gradient avec quatre distances par rapport aux arbres, deux distances ont été choisies : l'une immédiatement adjacente aux arbres et l'autre à mi-chemin entre eux. Cette modification était nécessaire car les arbres n'avaient été plantés qu'un an ou deux avant le début de la surveillance, de sorte que leur impact était surtout perceptible à courte distance. Les distances indirectes ne devaient pas être significatives dans ce contexte.
Des parcelles d'essai de 30 x 10 mètres ont été établies dans les deux systèmes et leurs contrôles respectifs. La longueur de 30 mètres a été choisie parce que certains échantillonnages de la biodiversité exigeaient que les sites soient distants d'au moins 10 mètres. En supposant que quatre répétitions soient souhaitées pour chaque variante, elles seraient situées le long d'un seul transect à des distances de 0 m, 10 m, 20 m et 30 m. La largeur de 10 m a été choisie en raison de la distance de 20 m entre les deux systèmes et de l'espacement entre les deux systèmes. La largeur de 10 mètres a été choisie en raison de l'espacement de 20 mètres entre les rangées d'arbres. L'échantillonnage a été planifié de manière à ce que le transect longe les arbres et atteigne le milieu du champ arable (voir les figures 1 à 3). La même disposition a été appliquée à la zone de contrôle, bien que le champ soit uniforme sur toute sa surface.
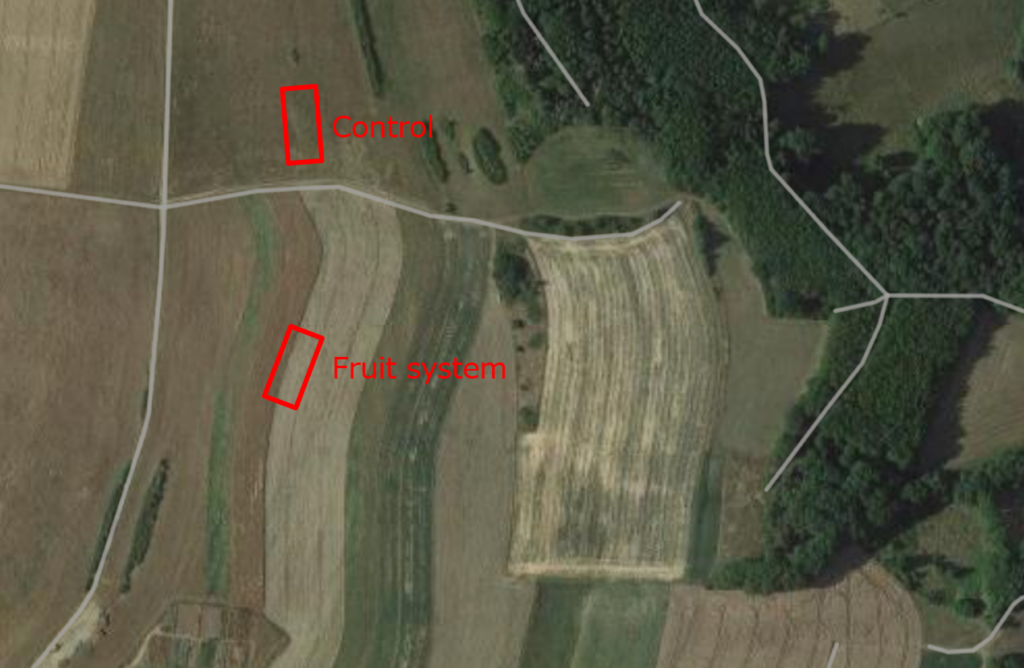
Fig. 2. Parcelles d'essai dans le système de fruits mélangés et le contrôle

Fig. 3 Localisation précise des sites d'échantillonnage dans le système de noix mixtes

Fig. 4 Mesure de la longueur et de la largeur de la parcelle d'essai
La surveillance a commencé par les méthodes les moins invasives, à savoir la collecte d'insectes. Cette enquête a été menée sur trois transects de 10 mètres dans chaque parcelle d'étude (Fig. 5). Un filet entomologique spécialisé a été utilisé, avec un manche d'un mètre et une ouverture en forme de cœur de 30 x 40 cm. Cette conception a facilité la collecte d'insectes à la fois dans la végétation haute et sur les surfaces proches du sol. Le sac de collecte du filet est fabriqué à partir de mailles fines renforcées par un manchon en matériau robuste (Fig. 6). Les insectes recueillis au cours de l'étude ont été transférés dans des récipients de 100 ml, euthanasiés et conservés à l'aide d'éthanol 75% (Fig. 7). Au total, 36 échantillons ont été collectés et l'identification de ces insectes sera réalisée ultérieurement dans le cadre de la tâche 3.2.

Fig. 5 Localisation des transects de collecte d'insectes

Fig. 6 Filet entomologique en cours d'utilisation

Fig. 7 Échantillons collectés à l'aide d'un filet entomologique
Le premier jour de la surveillance, une autre tâche consistait à déployer des pièges pour la collecte d'insectes au cours des cinq jours suivants. Deux types de pièges ont été utilisés : Les pièges à terre Barber et les pièges à pollinisateurs jaunes. Ces pièges ont été espacés tous les 10 mètres le long des transects désignés, avec trois pièges par variante (Fig. 8). Les pièges en terre de Barber, d'un diamètre de 10 cm, ont été conçus pour capturer efficacement les insectes terrestres. Les pièges à pollinisateurs jaunes, d'un diamètre de 30 cm, ont été placés directement sur le sol en raison de la faible hauteur de la végétation. Les deux types de pièges ont été remplis aux deux tiers d'une solution d'eau propre et de détergent inodore (Fig. 9). Cette solution permet de noyer rapidement les invertébrés tout en évitant les débordements en cas de fortes pluies, sans qu'il soit nécessaire de couvrir les pièges en raison de la courte période de collecte. Les niveaux d'eau ont été réapprovisionnés quotidiennement afin d'éviter une évaporation complète.
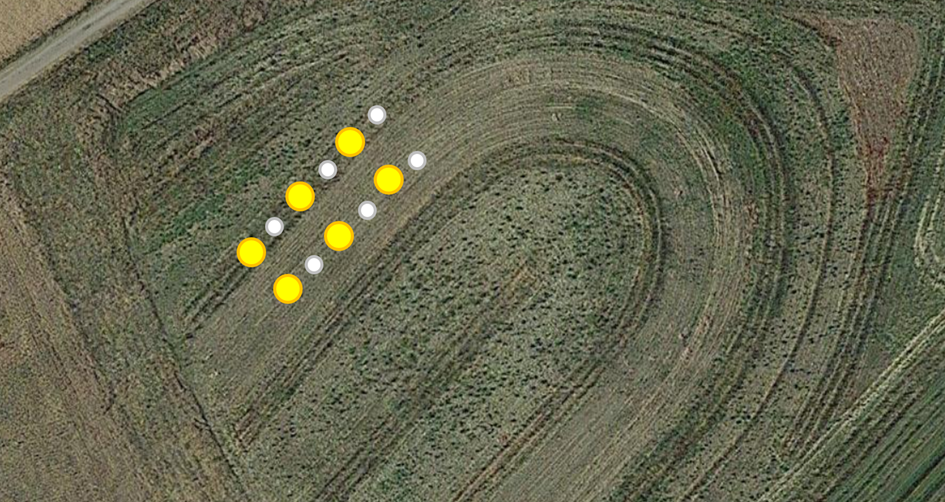
Fig. 8 Emplacement des pièges Barber et des bols jaunes dans le système à noix mixtes

Fig. 9 Le processus de mise en place des bols jaunes et des pièges Barber
Deuxième jour de contrôle (23.04.2024): L'évaluation s'est concentrée sur la biodiversité de la flore et la production primaire. Dans chacun des huit transects, quatre points ont été sélectionnés pour des photos phytosociologiques à l'aide d'un cadre botanique de 1×1 mètre (Fig. 10). Toutes les espèces végétales ont été identifiées et leur abondance a été estimée conformément aux lignes directrices du protocole de terrain recommandé. Les données ont été enregistrées sur des formulaires de terrain (Fig. 11).

Fig. 10 Distribution de la biodiversité et de l'échantillonnage de la biomasse dans le système mixte de noix

Fig. 11 Cadre botanique et formulaire de terrain utilisés pour l'évaluation de la flore
La biomasse située dans les mêmes cadres de mètres a été coupée, récoltée et pesée (Fig. 12). Cela a permis d'estimer le rendement des cultures fourragères pour les poulets au pâturage ou d'évaluer la productivité naturelle de l'écosystème (production primaire) si la biomasse n'avait pas été récoltée. Au moment du suivi, aucun rendement n'a été obtenu des arbres présents, et les champs de céréales n'ont pas été ensemencés. En outre, une documentation photographique des espèces végétales individuelles dans chaque système et de leur contrôle a été réalisée (Fig. 13). Ces photos ont été téléchargées sur iNaturalist pour la vérification de l'identification des espèces, qui utilise des algorithmes et la consultation de spécialistes. Les observations ont été géolocalisées afin de faciliter les comparaisons de la biodiversité au niveau mondial (Fig. 14).

Fig. 12 Biomasse fourragère récoltée par 1m2

Fig. 13 Documentation photographique individuelle des plantes
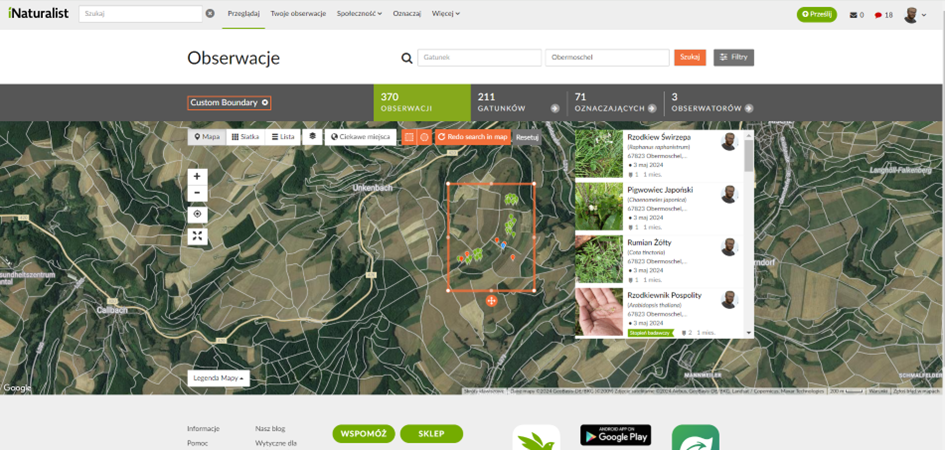
Fig. 14 Observations saisies sur iNaturalist
Troisième jour de contrôle (01.05.2024) - Les activités se sont concentrées sur l'étude de la profondeur du sol et la collecte de vers de terre. Des blocs de sol mesurant 25 x 25 x 25 cm ont été excavés dans les zones où la biomasse avait été collectée la veille (Fig. 15). Le sol a été soigneusement séparé sur une feuille et creusé davantage pour accéder au sous-sol. Pour les couches de sol plus profondes, un échantillonneur Egner a été utilisé si nécessaire (Fig. 16).

Fig. 15 Sites de collecte de vers de terre et mesures de la profondeur du sol

Fig. 16 Mesure de la profondeur du sol
Le sol étalé sur la feuille a été tamisé manuellement pour en extraire les vers de terre (Fig. 17). Les spécimens récupérés ont été conservés dans des récipients remplis d'alcool 75% en vue de leur pesée ultérieure et de l'identification des espèces (Fig. 18).

Fig. 17 Découpe du bloc de terre et tamisage de la terre pour les vers de terre

Fig. 18 Extraction des vers de terre
Jour 4 du contrôle (2 mai 2024) - Des mesures de la densité apparente et de la perméabilité du sol ont été effectuées. Les échantillons ont été prélevés en trois exemplaires à chaque endroit désigné (Fig. 19). Avant l'échantillonnage, de petites sections de gazon ont été nettoyées à l'aide d'une bêche. Deux types de cylindres ont été utilisés pour ces évaluations. De petits cylindres d'un diamètre de 5 cm ont été enfoncés dans le sol pour obtenir des échantillons de densité en vrac (Fig. 20). Les échantillons ont été scellés avec des couvercles aux deux extrémités et seront envoyés au laboratoire des sols pour analyse à une date ultérieure.
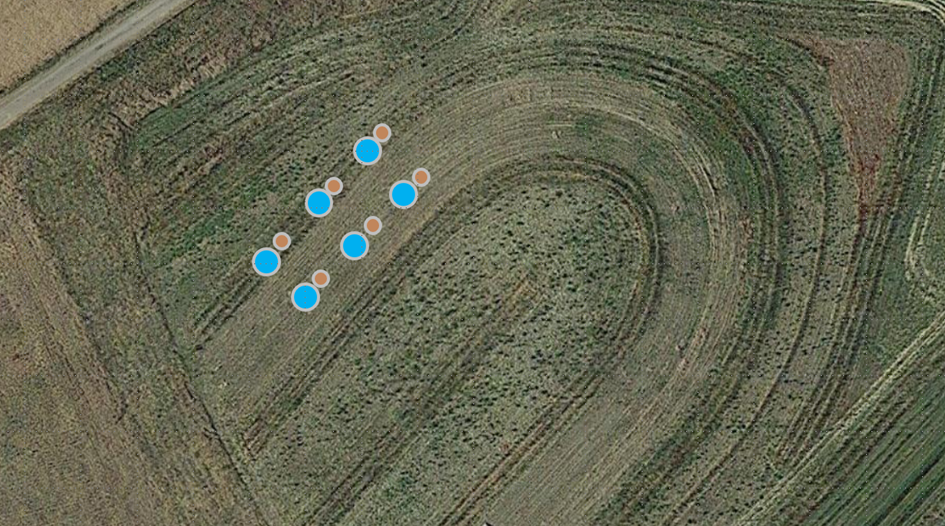
Fig. 19 Schéma de la collecte des cylindres de sol et des tests de perméabilité

Fig. 20 Collecte de cylindres pour la densité apparente du sol
La perméabilité du sol a été évaluée à l'aide de cylindres de 10 cm de diamètre enfoncés à pleine profondeur dans le sol, en laissant 2,5 cm exposés avec un bouchon en bois (Fig. 21). Ensuite, 100 ml d'eau ont été versés dans le cylindre et le temps total d'infiltration a été mesuré à l'aide d'un chronomètre. Ces mesures ont été consignées sur les formulaires de données de terrain.

Fig. 21 Mesure de la perméabilité du sol
Cinquième jour de contrôle (3 mai 2024) - L'accent a été mis sur l'achèvement de la collecte des pièges à insectes et de l'échantillonnage du sol. Les échantillons d'insectes provenant des bols jaunes et des pièges de sol ont été filtrés et transférés dans des récipients scellés avec de l'éthanol 75% (Fig. 22). L'identification des espèces d'insectes sera effectuée ultérieurement.

Fig. 22 Collecte de pièges à insectes
L'échantillonnage du sol a suivi les directives du protocole de terrain Task 3.2, avec quatre échantillons prélevés dans des sacs en plastique sur chaque variante. Chaque échantillon se composait d'au moins cinq carottes prélevées à l'aide d'un échantillonneur Egner (Fig. 23). Les échantillons ont été extraits jusqu'à une profondeur de 30 cm. Après la collecte, les échantillons de sol ont été stockés dans une glacière et congelés au retour de l'excursion sur le terrain. Les analyses des paramètres du sol seront effectuées en laboratoire à une date ultérieure.

Fig. 23 Schéma d'échantillonnage des sols (en haut) et un des cinq sous-échantillons (en bas)