Autor: Paweł Radzikowski radzikpawe@gmail.com

Primer día de control (29.04.2024): A su llegada al Living Lab alemán, el Sr. Paweł Radzikowski de Ogolnopolskie Stowarzyszenie Agrolesnictwa (OSA, Asociación Polaca de Agroforestería) se reunió con la Sra. Janine Raabe, agricultora de Hof Lebensberg. Se determinaron las ubicaciones precisas de los lugares de muestreo y se designaron los lugares de control. Los muestreos se realizaron en dos sistemas agroforestales: mixto-frutal y mixto-nogal. El control para el sistema mixto de nogales era un campo adyacente con un cultivo forrajero, mientras que el sistema mixto de frutales era un campo adyacente sin plantar. Durante las discusiones in situ, se decidió adaptar el protocolo de muestreo desarrollado originalmente en la Tarea 3.2 a las condiciones del lugar. En lugar de utilizar un gradiente con cuatro distancias desde los árboles, se optó por dos distancias: una inmediatamente adyacente a los árboles y otra a medio camino entre ellos. Esta modificación era necesaria porque los árboles se habían plantado sólo uno o dos años antes de que comenzara el seguimiento, por lo que su impacto era perceptible sobre todo a distancias cortas. No se esperaba que las distancias indirectas fueran significativas en este contexto.
Se establecieron parcelas de ensayo de 30 x 10 metros en ambos sistemas y sus respectivos controles. La longitud de 30 metros se eligió porque determinados muestreos de biodiversidad exigían que los lugares estuvieran separados por al menos 10 metros. Suponiendo que se desearan cuatro réplicas para cada variante, éstas se situarían a lo largo de un único transecto a distancias de 0, 10, 20 y 30 metros. La anchura de 10 metros se seleccionó debido a la separación de 20 metros entre las hileras de árboles. El muestreo se planificó de forma que el transecto discurriera junto a los árboles y llegara hasta la mitad del campo de cultivo (véanse las figuras 1 a 3). La misma disposición se aplicó a la zona de control, a pesar de que el campo era uniforme en toda su extensión.
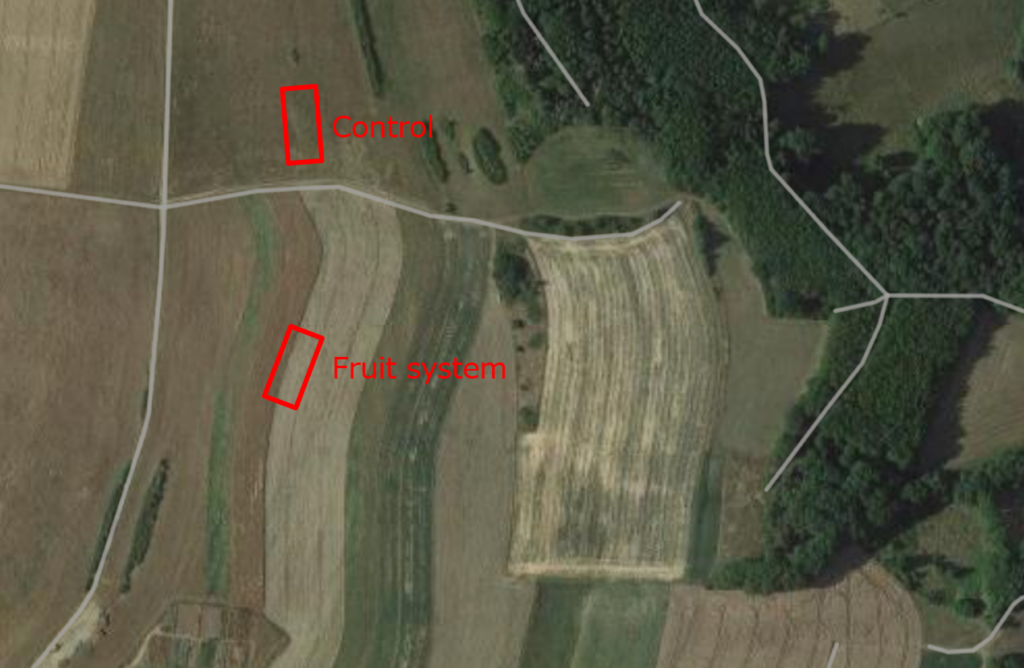
Fig. 2 Parcelas de ensayo en el sistema mixto y en el control

Fig. 3 Localización precisa de los lugares de muestreo en el sistema mixto de nueces

Fig. 4 Medición de la longitud y la anchura de la parcela de ensayo
El seguimiento comenzó utilizando los métodos menos invasivos, es decir, la recolección de insectos. Este estudio se realizó a lo largo de tres transectos de 10 metros en cada parcela de estudio (Fig. 5). Se utilizó una red entomológica especializada, con un mango de 1 metro y una abertura en forma de corazón de 30 x 40 cm. Este diseño facilitó la recolección de insectos tanto de la vegetación alta como de las superficies cercanas al suelo. La bolsa de recogida de la red está fabricada con una malla fina reforzada con una funda de material resistente (Fig. 6). Los insectos recogidos durante el estudio fueron transferidos a recipientes de 100 ml, eutanasiados y conservados en etanol 75% (Fig. 7). En total, se recogieron 36 muestras, y la identificación de estos insectos se llevará a cabo en la Tarea 3.2 en una fase posterior.

Fig. 5 Localización de los transectos de recogida de insectos

Fig. 6 Red entomológica en uso

Fig. 7 Muestras recogidas con una red entomológica
El primer día de control, otra de las tareas consistió en colocar trampas para la recolección de insectos durante los cinco días siguientes. Se emplearon dos tipos de trampas: Trampas de tierra Barber y trampas polinizadoras amarillas. Estas trampas se espaciaron cada 10 metros a lo largo de los transectos designados, con tres trampas por variante (Fig. 8). Las trampas de tierra Barber, con un diámetro de 10 cm, se diseñaron para capturar eficazmente insectos del suelo. Las trampas polinizadoras amarillas, de 30 cm de diámetro, se colocaron directamente sobre el suelo debido a la baja altura de la vegetación. Ambos tipos de trampas se llenaron hasta dos tercios con una solución de agua limpia y detergente inodoro (Fig. 9). Esta formulación de la solución garantizaba el rápido ahogamiento de los invertebrados al tiempo que evitaba el desbordamiento en caso de fuertes lluvias, sin necesidad de cubrir las trampas dado el corto periodo de recogida. Los niveles de agua se reponían diariamente para evitar la evaporación completa.
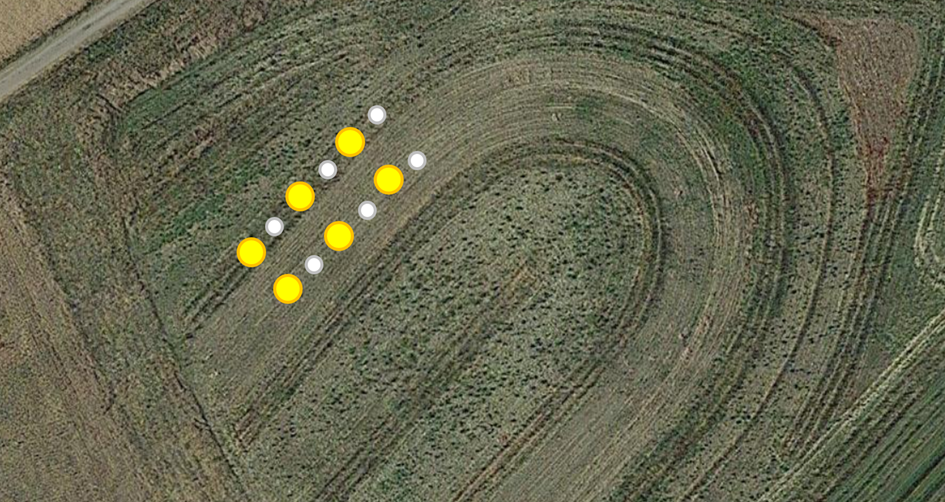
Fig. 8 Ubicación de las trampas Barber y los cuencos amarillos en el sistema mixto de nueces

Fig. 9 El proceso de colocación de los cuencos amarillos y las trampas Barber
Segundo día de control (23.04.2024): La evaluación se centró en la biodiversidad de la flora y la producción primaria. Dentro de cada uno de los ocho transectos, se seleccionaron cuatro puntos para tomar fotografías fitosociológicas utilizando un marco botánico de 1×1 metros (Fig. 10). Se identificaron todas las especies vegetales y se estimó su abundancia siguiendo las directrices del protocolo de campo recomendado. Los datos se registraron en formularios de campo (Fig. 11).

Fig. 10 Distribución de la biodiversidad y muestreo de biomasa en el sistema mixto de nogales

Fig. 11 Marco botánico y formulario de campo utilizados en la evaluación de la flora
La biomasa dentro de los mismos marcos métricos fue cortada, cosechada y pesada (Fig. 12). Esto permitió estimar el rendimiento de los cultivos forrajeros para los pollos de pastoreo o evaluar la productividad natural del ecosistema (producción primaria) si no se había cosechado la biomasa. En el momento del seguimiento no se obtuvo rendimiento de los árboles presentes ni se sembraron los campos de cereal. Además, se realizó una documentación fotográfica de las especies vegetales individuales en cada sistema y su control (Fig. 13). Estas fotos se subieron a iNaturalist para la verificación de la identificación de las especies, que utiliza algoritmos y la consulta a especialistas. Las observaciones se geoetiquetaron para facilitar la comparación de la biodiversidad a escala mundial (Fig. 14).

Fig. 12 Biomasa forrajera cosechada por 1m2

Fig. 13 Documentación fotográfica individual de las plantas
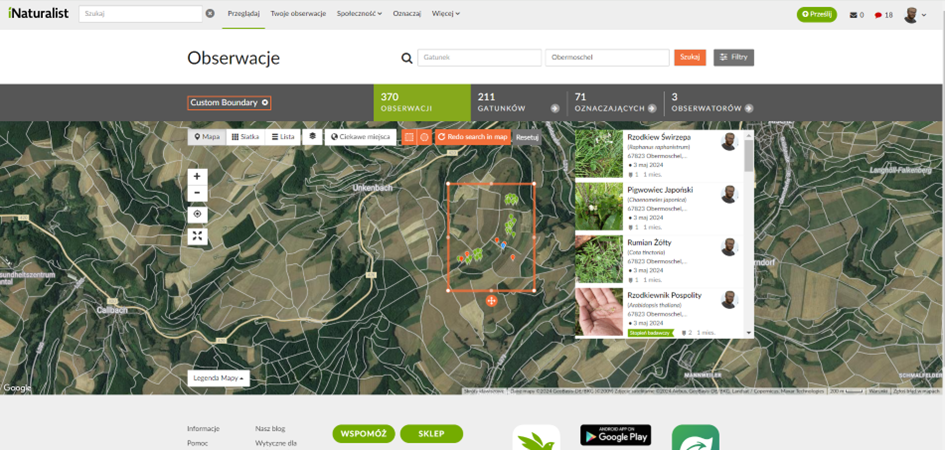
Fig. 14 Observaciones introducidas en iNaturalist
Día 3 de control (01.05.2024) - Las actividades se centraron en el estudio de la profundidad del suelo y la recogida de lombrices. Se excavaron bloques de suelo de 25 x 25 x 25 cm en las zonas donde se había recogido biomasa el día anterior (Fig. 15). El suelo se separó cuidadosamente en una lámina y se siguió excavando para acceder al subsuelo. Para capas de suelo más profundas, se empleó un muestreador Egner según fuera necesario (Fig. 16).

Fig. 15 Lugares de recogida de lombrices y mediciones de la profundidad del suelo

Fig. 16 Medición de la profundidad del suelo
La tierra extendida sobre la lámina se tamizó manualmente para extraer las lombrices (Fig. 17). Los especímenes recuperados se conservaron en recipientes llenos de alcohol 75% para su posterior pesaje e identificación de especies (Fig. 18).

Fig. 17 Corte del bloque de tierra y tamizado de la tierra en busca de lombrices

Fig. 18 Extracción de lombrices
Día 4 de control (2 de mayo de 2024) - Se realizaron mediciones de la densidad aparente y la permeabilidad del suelo. Se tomaron muestras por triplicado en cada lugar designado (Fig. 19). Antes de tomar las muestras, se limpiaron pequeñas secciones de césped con una pala. Para estas evaluaciones se utilizaron dos tipos de cilindros. Pequeños cilindros con un diámetro de 5 cm fueron clavados en el suelo para obtener muestras de densidad aparente (Fig. 20). Las muestras se sellaron con tapas en ambos extremos y se enviarán al laboratorio de suelos para su análisis en una fecha posterior.
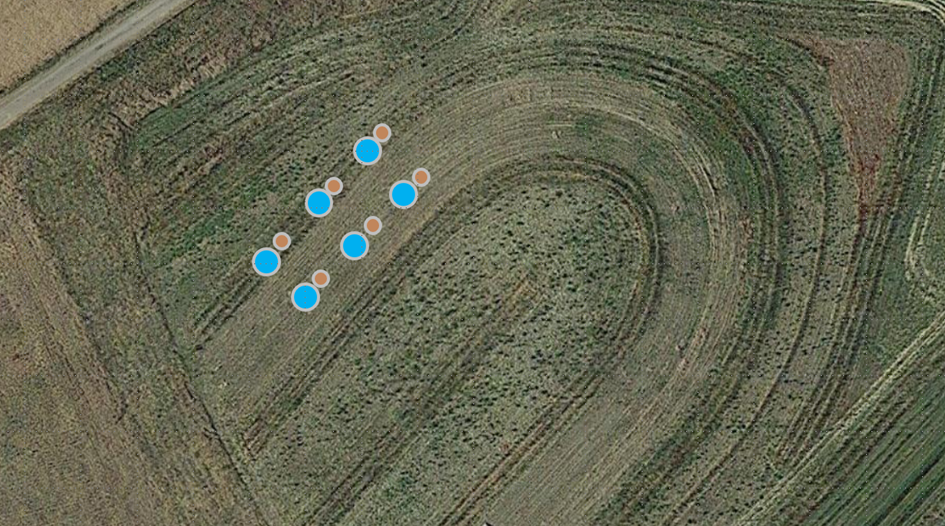
Fig. 19 Esquema de la recogida de cilindros de suelo y pruebas de permeabilidad

Fig. 20 Recogida de cilindros para la densidad aparente del suelo
La permeabilidad del suelo se evaluó utilizando cilindros de 10 cm de diámetro introducidos hasta el fondo en el suelo, dejando 2,5 cm expuestos con un tapón de madera (Fig. 21). Posteriormente, se vertieron 100 ml de agua en el cilindro y se midió el tiempo total de infiltración utilizando un cronómetro. Estas mediciones se registraron en los formularios de datos de campo.

Fig. 21 Medición de la permeabilidad del suelo
Día 5 de control (3 de mayo de 2024) - La atención se centró en completar la recogida de trampas para insectos y el muestreo del suelo. Las muestras de insectos de los cuencos amarillos y las trampas de suelo se colaron y se transfirieron a recipientes sellados con etanol 75% (Fig. 22). Más adelante se procederá a la identificación de las especies de insectos.

Fig. 22 Recogida de trampas para insectos
El muestreo del suelo siguió las directrices del protocolo de campo Tarea 3.2, con cuatro muestras recogidas en bolsas de plástico de cada variante. Cada muestra consistió en al menos cinco testigos tomados con un muestreador Egner (Fig. 23). Las muestras se extrajeron hasta una profundidad de 30 cm. Tras la recogida, las muestras de suelo se almacenaron en una nevera y se ultracongelaron al regreso de la visita de campo. Los análisis de los parámetros del suelo se realizarán posteriormente en el laboratorio.

Fig. 23 Esquema de muestreo del suelo (arriba) y una de las cinco submuestras (abajo)